プロテオ医学研究センターの東山繁樹教授と大学院医学系研究科の研究グループが東北大学,東京大学と連携し,Gタンパク質共役型受容体の活性化を網羅的に検出する手法を確立しました
愛媛大学プロテオ医学研究センターの東山繁樹教授と愛媛大学大学院医学系研究科の研究グループが東北大学,東京大学と連携し,Gタンパク質共役型受容体の活性化を網羅的に検出する手法を確立しました。
この手法により,新薬の開発が飛躍的に加速することが期待されます。
細胞は外界との情報の受け渡しを様々な分子を介して行います。細胞外からの情報を受け取るタンパク質は受容体と呼ばれ,その中でもGタンパク質共役型受容体(GPCR)と呼ばれる一群の受容体が極めて重要な役割を担っていることがわかっています。GPCRは全タンパク質の中で最大のファミリーを形成しており,ヒトゲノム中には800種類以上ものGPCR遺伝子が存在しています。GPCRは細胞膜上に存在し,細胞外から運ばれてくるホルモン,成長因子,脂質などの生理活性物質と結合し,細胞内へ信号(シグナル)を伝えています。また,GPCRの機能の異常は多くの疾患を引き起こすこと知られていることから,病態時のGPCRの機能異常を正すことは,病気の治療につながります。実際,GPCRを標的とした薬は数多く開発が成功しており,現在市販されている薬の半数近くにものぼります。従って,GPCRの機能を理解することは,創薬開発の近道であると言えます。GPCRの役割は細胞外の結合分子(リガンド)の量を感知して,細胞内へシグナルを伝えることです。GPCRはリガンドと結合すると構造変化(活性化)を起こし,三量体Gタンパク質と呼ばれる細胞内タンパク質を呼び寄せ,様々な下流のシグナルを誘導します。三量体Gタンパク質はGs,Gi,Gq,G12/13 の4種類に大別され,それぞれの下流では,サイクリックAMP 濃度の変動(Gs,Gi),細胞内カルシウム濃度の変動(Gq),低分子量Gタンパク質RhoへのGTP結合(G12/13)が起こります。このような細胞内イベントを検出することで,GPCRの活性化を測定することができます。しかし,GPCRは通常1種類か2種類の三量体G タンパク質としか結合(共役とも呼ばれます)しないことから,特定の細胞内イベントを観察するだけでは,多くても半数程度のGPCRの活性化しか検出することができません。そこで,多くのGPCRの活性化を同一の方法で検出できるような新規GPCR活性化測定法が期待されていました。特に,G12/13 の下流での細胞内シグナルを定量的に検出する手法の開発は遅れており,G12/13 と結合するGPCR の機能を解明する上で大きな障害となっていました。
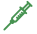
これまでに東山教授のグループは,細胞膜貫通型増殖因子TGFaの研究から,膜貫通型蛋白分解酵素TACEによるTGFaの切断高感度簡易測定法(TGFa shedding assay: TGFaシェデイング測定法,図1)を開発し,TGFaの切断がGPCRの活性化で引き起こされることを突き止めてきました。また,東北大学の青木淳賢教授のグループは,この現象が様々なGPCRの活性化で普遍的に起こる現象かどうかを,TGFaシェデイング測定法を用いて検討しました。その結果,116 種のリガンド既知のGPCRのうち104 種類(約90%,検出率として世界最高値)の活性化を測定することができました。さらに,本手法を用いてリガンド未知のオーファンGPCRのリガンド探索を行った結果,3つのGPCR(P2Y10,GPR174,A630033H20)が生理活性脂質のリゾホスファチジルセリンに応答することを発見しました(図2)。これらの受容体はいずれもG12/13 に共役すること,リゾホスファチジルセリンの構造類似体(東京大学の大和田智彦教授,新井洋由教授により有機合成)の反応性からリゾホスファチジルセリンの構造を厳密に認識する受容体であることも明らかにしました。リゾホスファチジルセリンは,リンパ球の増殖抑制やマスト細胞の活性化などの作用が知られており,これら3つのGPCRの研究を通じて生体内の新たな生理活性物質の解明が進むことが期待されます。
本研究成果は,GPCRを標的とした創薬開発を飛躍的に加速させるとともに,生理活性脂質リゾホスファチジルセリンの機能に関する研究の発展を確約するものとして注目されます。本研究成果は,米国の学術雑誌Nature Methods の10月号に掲載されます。また,9月17日付けでオンラインで公表されております。
 サイトマップ >
サイトマップ >  お問い合わせ >
お問い合わせ >  English >
English >