「生体電気」を再定義する-電気信号がもつ新たな役割への挑戦 (主に河合)
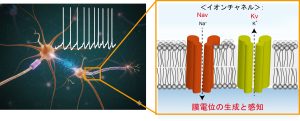
脳波や心電図からも分かるように、私たちの身体は至るところで微弱な「電気信号」を生成し、生命活動を維持しています。この電気の生成と感知機構は、長らく神経細胞などを中心として進められ、その主役は「電位依存性イオンチャネル」という分子群であることが分かっています。
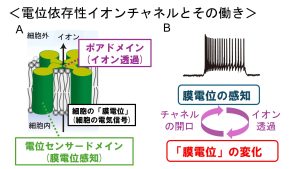
一般に電位依存性イオンチャネルは、細胞の膜電位(電気信号)を感知する電位センサードメインと、イオンを透過するポアドメインより構成されます(上図A)。これにより細胞の膜電位を感じて多様なイオンを通すことが出来るようになります。そしてこのイオンの透過はまた新たな膜電位変化を生み、細胞はダイナミックな「動き」を示すようになります(上図B)。このことからも「イオンチャネル=膜電位」という図式が成り立つこともうなずけます。
一方で後述するように、我々は近年の研究を通じ、生体内にはこの上記のメカニズムにも多様な形があることや、それどころか既知の分子モデルでは説明しきれない、全く別の電位感知メカニズムが存在していることも見出しました。 本研究室では、これまで見過ごされてきたこの「新たな電位感知機構」にスポットを当て、特定の器官に留まらず、幅広い生体組織を対象とした横断的な解明を目指しています。未来の教科書に新たな一頁を加えることを目指して、日々の研究に取り組んでいます。
-
神経細胞が示す「活動電位」の生成・感知機構について
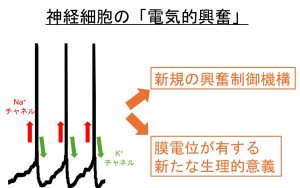
神経細胞が示す動的な膜電位変化として、活動電位が知られています。高校生物の教科書でも触れられている通り活動電位については、電位依存性Na+チャネルのダイナミックな開口、またそれに伴う電位依存性K+チャネルの開口が重要であることが知られています。しかし神経細胞の活動制御はこれらのイオンチャネルのみで行われるわけではありません。実際に我々は、近年内側手綱核(情動や忌避に関わる脳領域)とよばれる部位において、複数のチャネルが巧妙に組み合わさることで、「分単位」の長期的な活動制御が複数のイオンチャネルの働きによって可能となることを見出しています(詳細についてはKawai et al., Sci Adv, 2025)。このように活動電位一つをとってもその制御機構にはまだまだ知られていないメカニズムが存在していると思っています。また、今後はこのような神経細胞の膜電位が持つ生理的な意義についても、従来見過ごされてきたメカニズムを発掘していきたいと考えています。
-
「非興奮性細胞」がもつ電気信号の意義
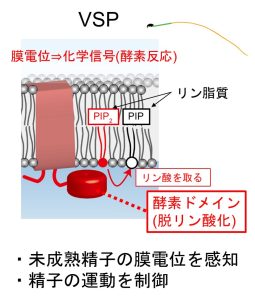
神経細胞や、心筋などの活動電位を生じる細胞を「興奮性細胞」といいます。「非興奮性細胞」とは活動電位を生じない細胞です。このような「非興奮性細胞」は、膜電位の顕著な変動こそ示さないものの、細胞膜をもつ以上は膜電位を有しています。しかしこのような「非興奮性細胞」がもつ膜電位の意義は興奮性細胞と比しても驚くほど分かっていません。一方で、我々は非興奮性細胞のひとつである精子において、電位依存性ホスファターゼ(VSP)と呼ばれる分子が機能していることを初めて示しました(Kawai et al., PNAS, 2019; Kawai et al., Nat Commun, 2024など)。VSPは上述の電位センサードメインにホスファターゼが連結しているという極めて独特な分子です(Murata et al., Nature, 2006)。我々は、精子がその成熟過程においてVSPを介して膜電位を感知し、成熟精子の運動制御に重要であることを見出しました。また上記VSPの他にも精子における様々な電位感知分子に着目し研究を進めているほか、免疫細胞など精子以外の非興奮性細胞にもプロジェクトを拡張していこうとしています。
病態下の神経生理学の諸問題の解決に向けて – 神経炎症・脳腫瘍の新規診断・治療の開発を目指して (主に矢野)
神経系の疾患の多くが難治性であり、21 世紀の今日においてもいまだにほとんど治療法がないものもあります。それは疾患の原因がはっきりしないこととともに、そもそも健常の神経系の理解も、いまだ不十分であることに起因していると考えられます。当教室ではこうした問題の解決に少しでも資することを目指した研究も行っています。
- ミクログリアが関与する神経炎症の理解・制御に向けて
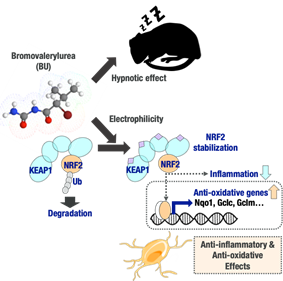
神経炎症が神経系疾患に関与しており、それを担う脳内の細胞がグリア細胞の一つであるミクログリアです。炎症は生理的な反応であるため、やみくもに抑制すればよいというものではありませんが、それが疾患の成因となる場合には制御が必要と考えられるため、これまでに神経炎症が起こるしくみの探求、それを制御しうる薬剤の探索、およびその抗酸化的・抗炎症的転写因子 NRF2 活性化剤としての作用機序解析 (Takeda et.al., BBRC 2022., Takeda et.al., J. Biochem., 2023) を行ってきました。
最近、マクロファージの炎症反応におけるネガティブフィードバック機構としての「超硫黄分子」の役割が東北大学から報告 (当教室の卒業生 武田が参加、Takeda et.al., Redox Biol. 2023) されましたが、ミクログリアにおいても同様の機構が存在するのか否か、抗炎症剤の作用機序との関連はどのようであるか、追及しています。
- 脳腫瘍の新規診断・治療の開発に向けて
一口に脳腫瘍と言っても様々な病型があり、治療法が大きく異なることがあります。そのため治療に先立って病型が詳細にわかることに大きな意味があります。近年では遺伝子変異に基づく病型の分類指標が確立しており、それに沿えば診断は確定できます。しかしながら脳は頭蓋骨の中に格納されていて、外科的なアクセスにおいて他の臓器にない障壁があります。画像診断技術の進展はこうした問題に大きく貢献してきましたが、それでもいまだに原則として病型の確定は生検によっています。せめて術中に迅速に病型が確定できたり、術前に遺伝子変異が検出できれば、生検や治療の位置づけが変わって来ることが期待されます。現在われわれは脳神経外科との共同研究により、生検試料や脳脊髄液中からの遺伝子変異検出技術の開発を行っています。
またがん治療という観点では、耳鼻咽喉科・頭頸部外科との共同により、頭頸部扁平上皮がんのリンパ節転移を抑止することを目指した、治療標的分子の探索も行ってきました。現在は腫瘍細胞が発現するこれらの因子を抑制することで得られた宿主免疫との関係性の変化について追及しています。