愛媛大学医学部附属病院臨床研究支援センターは、全科の専門医師とともに臨床試験を推進します。(センター長 永井 将弘)


当院様式の申請書(エントリーフォーム)、審査結果通知書、審査書類一式(研究計画書、同意説明文書、オプトアウト文書など)
| 様式 | 書類名 | DL |
|---|---|---|
| 1 | 実施申請書 | excel (エントリーフォーム) |
| 2 | 報告申請書 | |
| 4 | 研究実施状況報告書 | |
| 5 | 研究 [終了・中止] 報告書 | |
| 6 | 研究分担者・研究協力者リスト | word |
| 10-1 | 臨床研究等に伴う重篤な有害事象に関する報告書 | word |
| 10-2 | 予測できない重篤な有害事象報告 | word |
| 11 | 新たな安全性情報等に関する報告書 | word |
| 12 | 研究実施の適正性等に関する報告書 | word |
中央一括倫理審査における手続き及び審査は、以下のような流れで行います。
事前にご確認の上、申請書類をご準備ください。
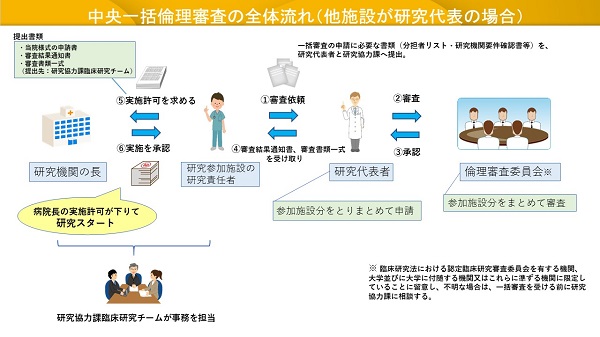
研究代表者から、一括審査の申請に必要な手続き・書類が通知されます。
研究代表者へ提出する書類を、研究協力課にも提出してください。
・分担者リスト
・研究機関要件確認書 等
新規申請では、下記の書類を研究協力課まで電子ファイルにてご提出ください。
・実施申請書 (エントリーフォーム(excel)を入力)
・研究分担者・研究協力者リスト (word 様式6)
・審査結果通知書
・審査書類一式
(研究計画書、同意説明文書、オプトアウト文書など、宛先・問い合わせ先に当院の情報を入れたもの)
変更申請では、下記の書類を研究協力課まで電子ファイルにてご提出ください。
・報告申請書 (エントリーフォームに変更後の計画書、説明書等の版数・作成日を入力)
・審査結果通知書
・審査書類一式
(研究計画書、同意説明文書、オプトアウト文書など、宛先・問い合わせ先に当院の情報を入れたもの)
研究の終了(中止)の際には、下記の書類を研究協力課まで電子ファイルにてご提出ください。
・研究[終了・中止]報告書 (エントリーフォームexcel内 様式5)
➡ 愛媛大学医学部研究協力課臨床研究チーム
(愛媛大学医学部附属病院 外来棟3F 臨床研究品質・情報統括室)
受付時間:月曜~金曜 8:30~17:15(土日祝日を除く)
