当講座の研究は、学位取得後は個々の専門性や関心領域に応じて自由なテーマで取り組んでいます。大学院生や学位取得前の場合は、やりたいテーマを考慮して、最も適切な指導教員に師事するようにしています。2023年4月時点の教員の科研費課題名等は以下の通りです。

大八木教授:基盤C(2023〜2025)
アルツハイマー病のインスリンシグナリング標的治療:モデルマウスにおける解析
越智博文教授(難病・高齢医療学講座):基盤C(2021〜2023)
末梢血濾胞性ヘルパーT細胞を利用した視神経脊髄炎の多面的モニタリングの開発発
越智雅之准教授:基盤C(2021〜2024)
サルコペニア・動脈硬化・認知機能低下の新規治療標的としてのAGEsの探求
三浦講師:基盤C(2023〜2026)
眼症状を伴う遺伝性神経筋疾患の新規疾患単位の確立
岡田特任講師:若手(2022〜2025)
自己免疫性神経疾患における血管内皮機能障害の解析と治療標的の検討
以下に、それぞれの主要な研究の概略を紹介します。
アルツハイマー病の治療薬の探索 ~特にアポモルフィンについて~
研究者:大八木教授
アルツハイマー病(AD)は高齢者認知症の60%以上を占める主要疾患です。AD脳で特徴的に見られる病理所見として、アミロイドβ蛋白(Aβ)を主成分とする老人斑と過剰リン酸化タウ蛋白(p-tau)を主成分とする神経原線維変化(NFT)が挙げられます。特に、最初期に形成・蓄積すると考えられていたAβを標的とするβ-/γ-セクレターゼ阻害薬、凝集阻害薬、抗体、ワクチンなどがこれまで多数開発されましたが、ADの認知機能の改善効果に関しては、ほぼ全ての薬剤が不成功に終わりました。したがって、Aβ以外の治療標的を考える必要があります。
私たちは2011年にドパミンアゴニストの一つであるアポモルフィン(APO)の皮下注射でADモデルの3xTg-ADマウスの認知機能とAD病理の改善を報告しました(文献1) (図1)。
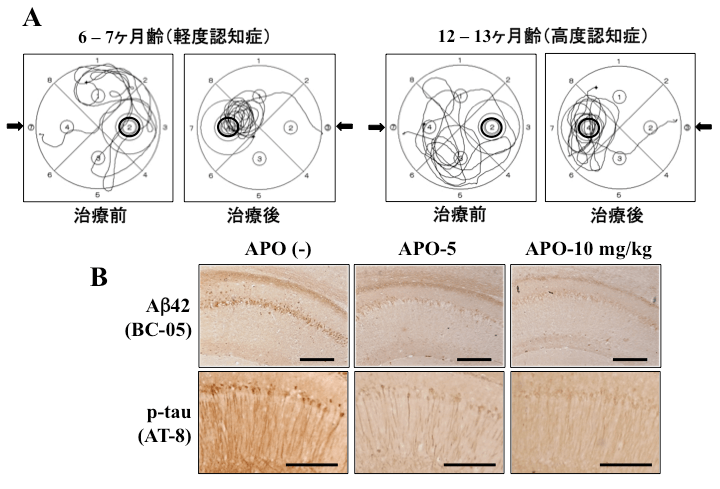
6ヶ月齢および12ヶ月齢の3xTg-ADマウスにAPO 5 mg/kgを週1回皮下注射を1ヶ月間(計4回)行いました。モリス水迷路の遊泳奇跡解析では、APO治療後はゴール台場所の記憶が改善しました(A)。海馬の免疫染色では、神経細胞内のAβ42 (BC-05抗体)およびリン酸化タウ蛋白(AT-8抗体)の減少が見られました(B)。Scale bars = 100 μm
さらに2017年に、APO治療は神経細胞のインスリン抵抗性を改善することが効果ポイントの一つであることを報告しました(文献2) (図2)。世界的にADと糖尿病の病態の共通性が提唱されており、ADは「3型糖尿病」や「脳の糖尿病」と称されています。私たちはAD脳内の病態の主因がインスリンシグナリング障害と考え、この観点からAPO以外にも薬剤候補の探索を進めています。
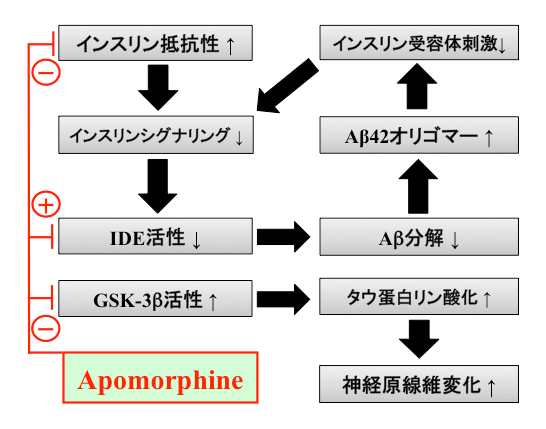
脳神経細胞のインスリン抵抗性が上昇し、インスリンシグナリングが低下するとIDE活性低下及びGSK-3β活性上昇が生じて、Aβやリン酸化タウ蛋白の形成・蓄積が促進します。Aβオリゴマーの増加はさらにインスリンシグナリングを阻害します。APOはこの分子病態の悪循環を抑制すると考えられます。
文献
- Himeno E, Ohyagi Y, et al. Apomorhine treatment in Alzheimer mice promoting amyloid-b degradeation. Ann Neurol 69: 248-256, 2011.
- Nakamura N, Ohyagi Y, et al. Apomorphine therapy for neuronal insulin resistance in a mouse model of Alzheimer’s disease. J Alzheimers Dis 58: 1151-1161, 2017.
- OhyagiY, Miyoshi K, Nakamura N. Therapeutic strategies for Alzheimer’s disease in the view of diabetes mellitus. Adv Exp Med Biol 1128: 227-248, 2019.
- Imamura T, Yanagihara YT, Ohyagi Y, et al. Insulin deficiency promotes formation of toxic amyloid-β42 conformer co-aggregating with hyper-phosphorylated tau oligomer in an Alzheimer’s disease model. Neurobiol Dis 137: 104739, 2020.
多発性硬化症免疫病態の制御~制御性細胞による治療の可能性~
研究者:越智博文先生
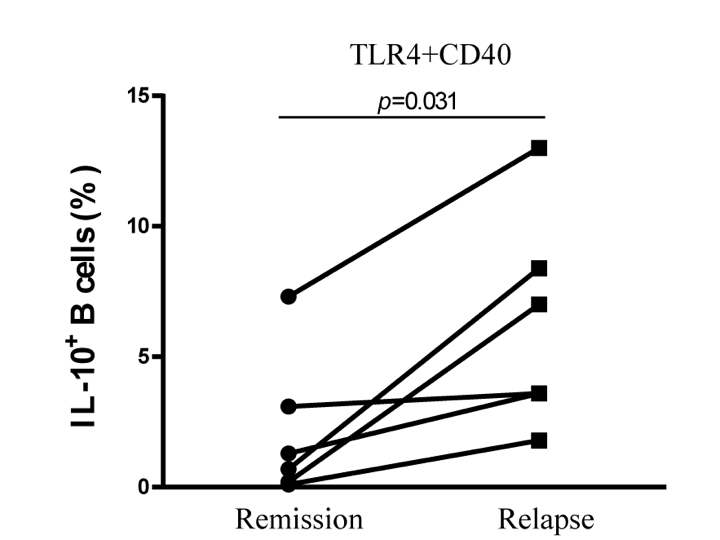
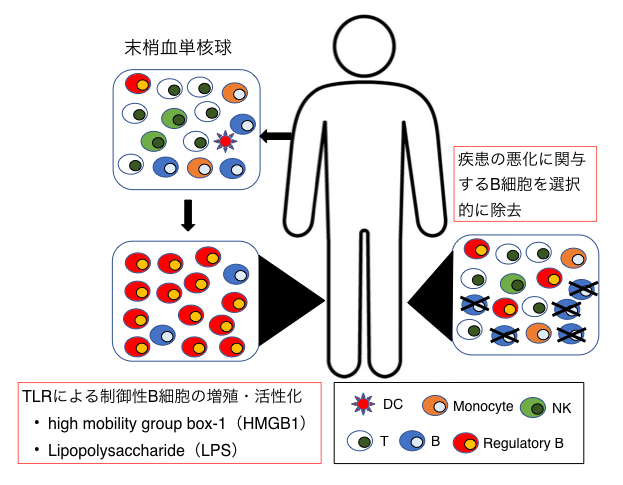
多発性硬化症は(MS)は再発と寛解を繰り返す中枢神経の慢性炎症性脱髄疾患です。中枢神経髄鞘抗原に対するT細胞が介在する自己免疫疾患と考えられてきましたが、B細胞除去療法が再発予防と進行抑制に有効であることから、B細胞が病態悪化に寄与していることが注目されています。一方、B細胞の中には、IL10を産生し免疫反応を制御する制御性B細胞が存在することが指摘されています。我々は、リポ多糖(LPS)によるToll様受容体4(TLR4)とCD40リガンドによるCD40の共刺激によってIL10産生制御性B細胞が誘導できることを明らかにし、再発期MSではこの制御性B細胞が増加することを明らかにしました(図1・2)(文献1)。また、微生物由来のLPS以外に、high mobility group box-1(HMGB1)による刺激でもIL10産生B細胞が誘導できることも確認しています。HMGB1は炎症や組織障害に伴い細胞外に放出される内在性蛋白質であることから、MS病態にも関与している可能性があります。現在、内在性のTLR4リガンドであるLPSとHMGB1のMS患者における生体内動態と、これらのリガンドによって誘導されるIL10産生制御性B細胞の免疫動態やその表面マーカーの決定に関する研究を進めています。こうした研究を通して、IL10産生制御性B細胞の機能制御を介したMSの新規免疫細胞療法の開発や、疾患増悪に関係するB細胞の選択的除去療法を目指しています(図3)。

また、我々が世界で初めて同定した抗CD3抗体によって誘導されるlatency-associated peptide(LAP)陽性制御性T細胞を標的とした免疫介在性疾患の治療に関する研究も進めています(文献2)。最近の研究では、LAP陽性制御性T細胞の誘導にはXCR1陽性伝統的樹状細胞1とγδT細胞とのXCR1-XCL1相互作用が重要であることが明らかになっています(図4)(文献3)。
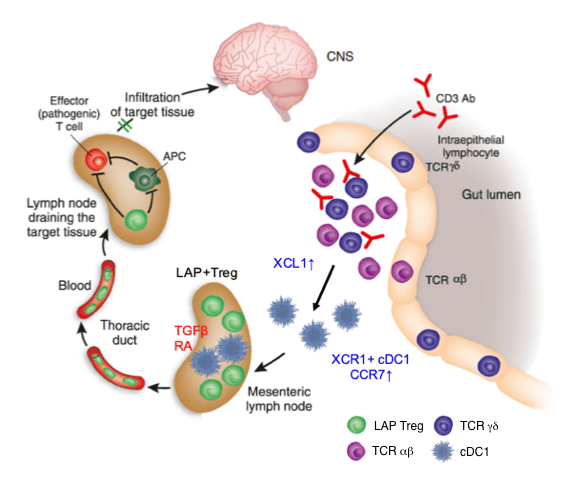
文献
- Okada Y et al. Signaling via toll-like receptor 4 and CD40 in B cells plays a regulatory role in the pathogenesis of multiple sclerosis through interleukin-10 production. J Autoimmun.2018;88:103-113.
- Ochi H et al. Oral CD3-specific antibody suppresses autoimmune encephalomyelitis by inducing CD4+ CD25- LAP+ T cells. Nat Med. 2006;12(6):627-635.
- Rezende RM et al. γδT Cell-Secreted XCL1 Mediates Anti-CD3-Induced Oral Tolerance.I Immunol 2019 Oct 2. pii: ji1900784. doi: 10.4049/jimmunol.1900784.
サルコペニアとフレイルに関連する因子の探求
研究者:越智雅之講師
高齢者の身体機能の低下要因として筋力低下(サルコペニア)は重要であり、さらに体重や活動性低下を加えたフレイルとともに、動脈硬化症や認知症の発症・進行との関連性が提唱されています。サルコペニアやフレイルの発症には、年齢、生活習慣、酸化ストレス、インスリン抵抗性、低テストステロンなどが関与しています。
一方、これらの因子は動脈硬化や認知症の発症・進展にも関与している。愛媛大学病院抗加齢・予防医療センターで蓄積した地域の高齢者の臨床データをもとに、サルコペニア、フレイル、動脈硬化、インスリン抵抗性・分泌および認知機能障害の相関関係について検討を行っています。
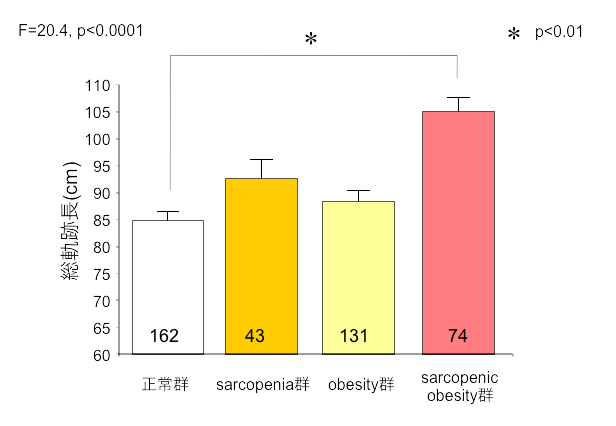
サルコペニアと肥満が重複すると転倒リスクが急上昇します。
※重心動揺総軌跡長 : 重心動揺検査の項目で、一定時間でのふらつき度合いを示す。長いほどふらついている。
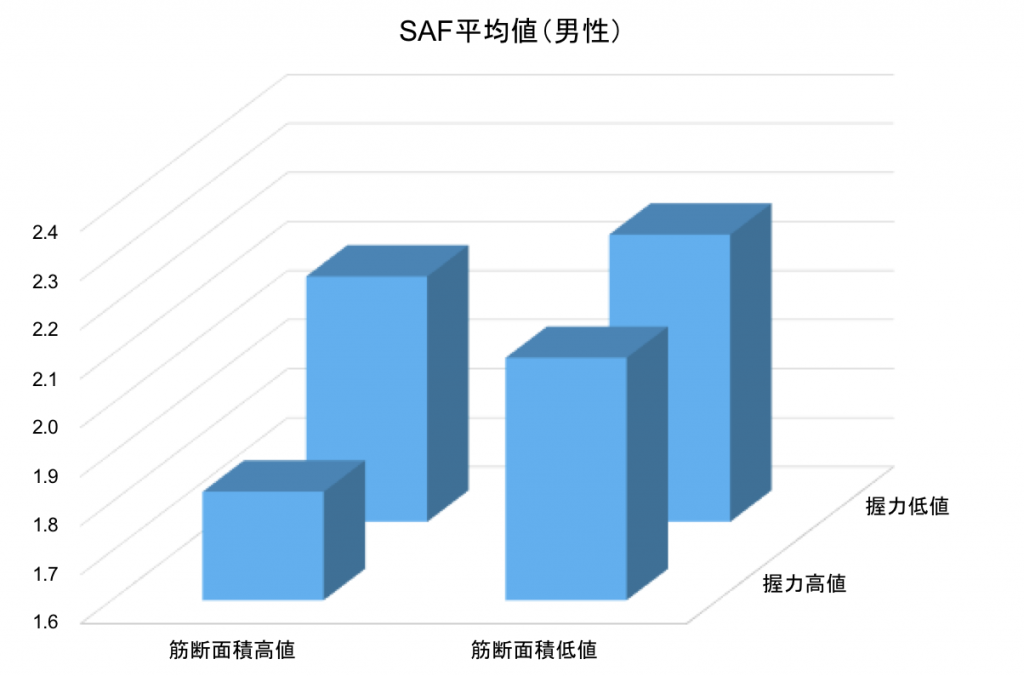
各サルコペニア指標とAGEsは関連がみられ、サルコペニアが進んでいるとAGEs蓄積がすすんでいる。
握力高値・筋断面積高値群に比べ、握力低下/筋断面積低値群でAGEs蓄積が有意に高値であった(カットオフ値;握力37.0kg、筋断面積271.8cm2)
※AGEs : Advanced glycation endoproductsの略で、終末糖化産物。加齢や摂取物などにより体内に蓄積する。近年老化関連マーカーとして注目されている。
遺伝性神経疾患の責任遺伝子変異解明
研究者:三浦講師
『疾患』は『遺伝要因』と『環境要因』の組み合わせで生じると考えられます。いわゆる単一遺伝病というのは『遺伝要因』がほぼ100%であり、一方、サリン中毒などは『環境要因』がほぼ100%の疾患といえます。この講座では、『遺伝要因』にspotをあて、遺伝解析・遺伝子変異機能解析などを行い、『遺伝学的に(and/or臨床的に)新たな疾患単位確立』をし、最終的には治療法を開発することを目指しています。

疾患の責任遺伝子変異を同定する意義
- 疾患発症の分子基盤解明の第一歩となる
- 分子基盤が解明すれば治療法開発につながる
疾患遺伝解析のおおまかな流れ
- 遺伝性疾患であると疑う
- 既知の疾患責任遺伝子変異がないか調べる
- 家系を集め、遺伝学的解析をする
- 新しい責任候補遺伝子変異を同定する
- 責任候補遺伝子変異について機能解析をする
稀少遺伝性神経疾患研究の具体例
1. 臨床像を押さえる
典型的な緩徐進行性の痙性対麻痺
2. 家系調査
両親が血族婚(常染色体劣性遺伝の可能性大)
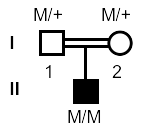
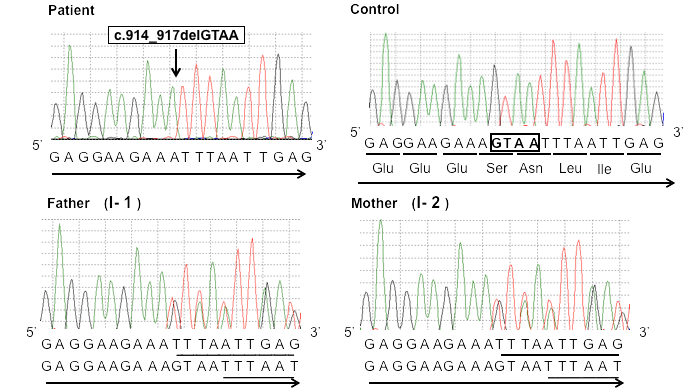
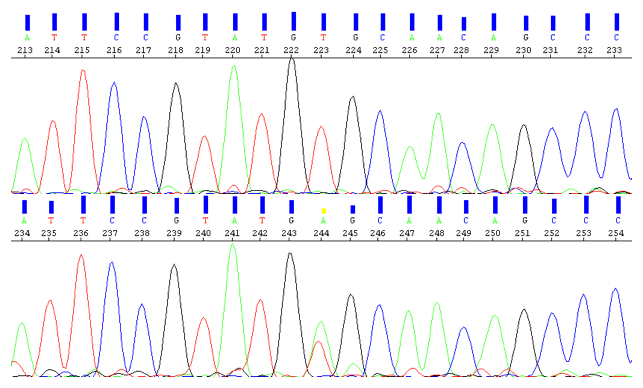
3. 世界初の遺伝子変異の発見
機械で遺伝子の塩基配列を読み取ると患者ではGTAAの4塩基が完全欠失している。両親は半分ずつ欠失している。
4. 世界初の遺伝子変異の発見
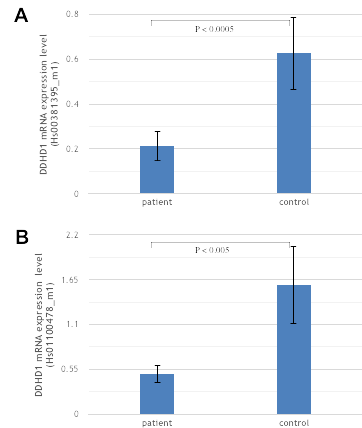
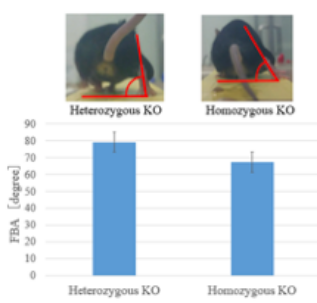
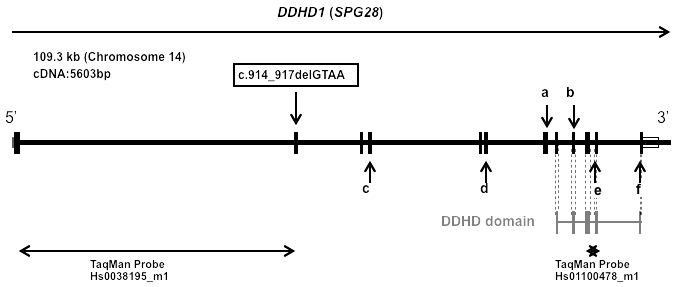
5. 論文発表
遺伝学的・臨床的に新規の遺伝性神経疾患研究の具体例
1. 臨床像を押さえる
下肢近位筋優位・排尿障害・発作性空咳を来す遺伝性運動感覚ニューロパチー
2. 臨床像に加えて検査・画像・病理をおさえる
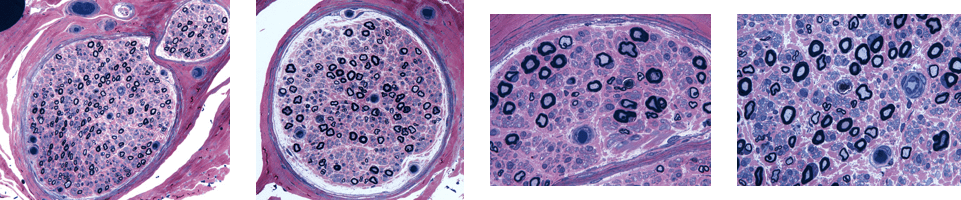
3. 家系調査
常染色体優性遺伝
4. 疾患責任候補遺伝子変異を同定
A 責任遺伝子は第1番染色体にありそう
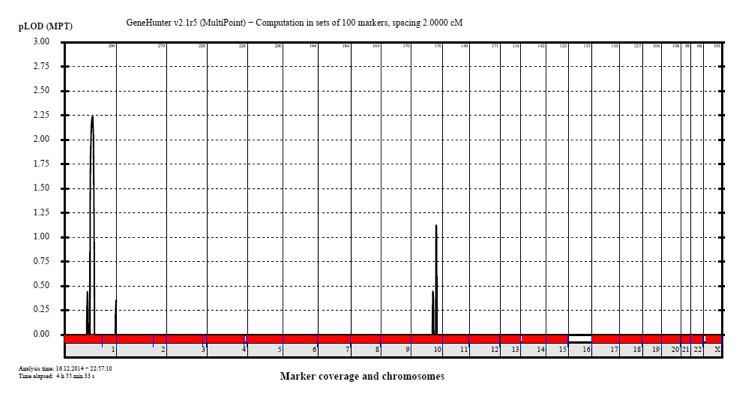
B コンピュータ解析により患者特異的な変異を割り出す
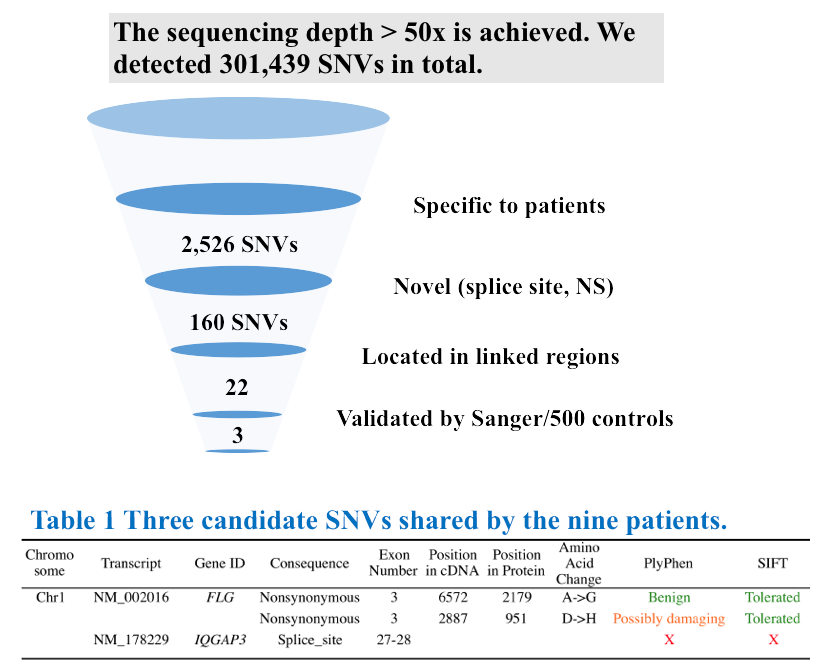
C 患者さんの点変異を確認
5. 責任候補遺伝子の機能解析
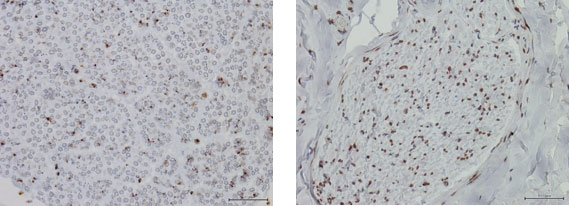
6. 論文発表
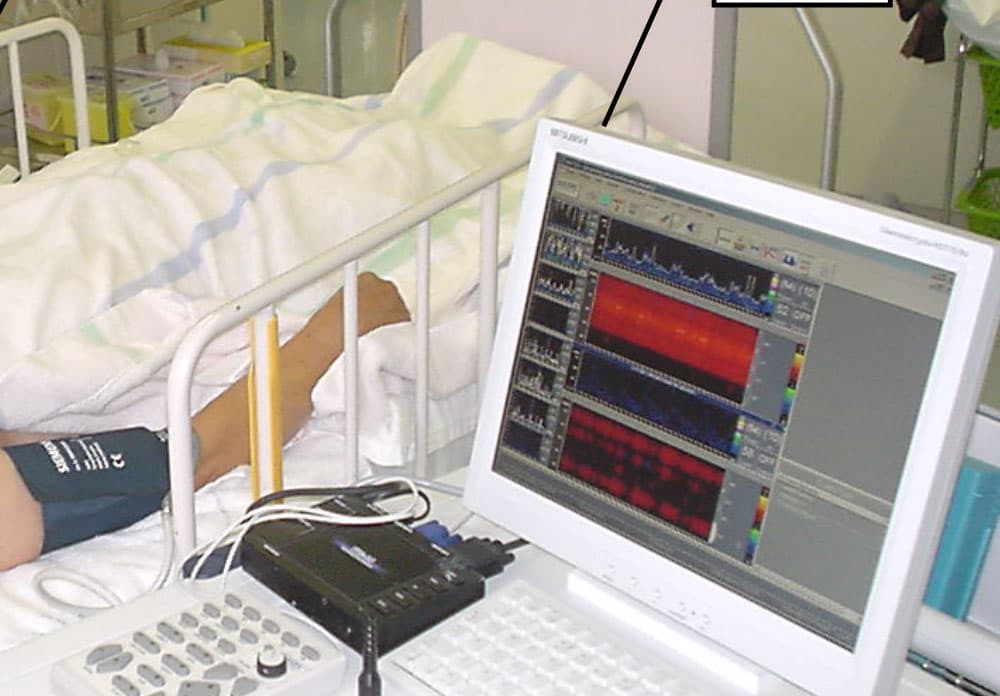
神経疾患における超音波を用いた血管内皮機能の検討
研究者:岡田特任講師
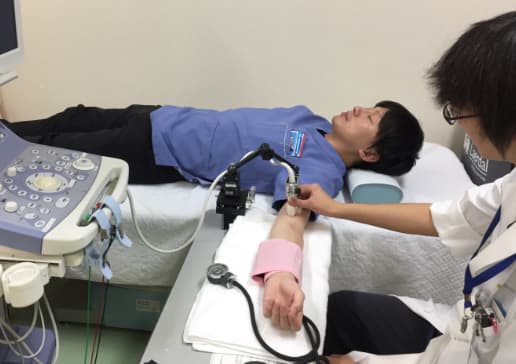
血管内皮機能を超音波を用いて解析し,神経疾患の種類や重症度との関連を検討します。認知症では血管内皮機能との関係が少し報告され始めていますが、さらに詳しく、またほかの神経疾患との関係についても研究しています。
FMD
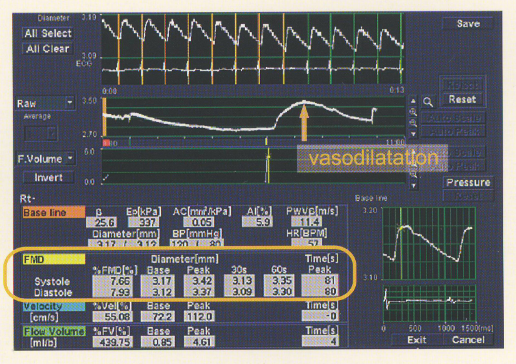
BHI
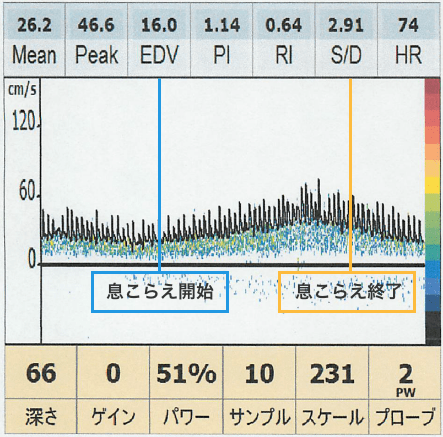
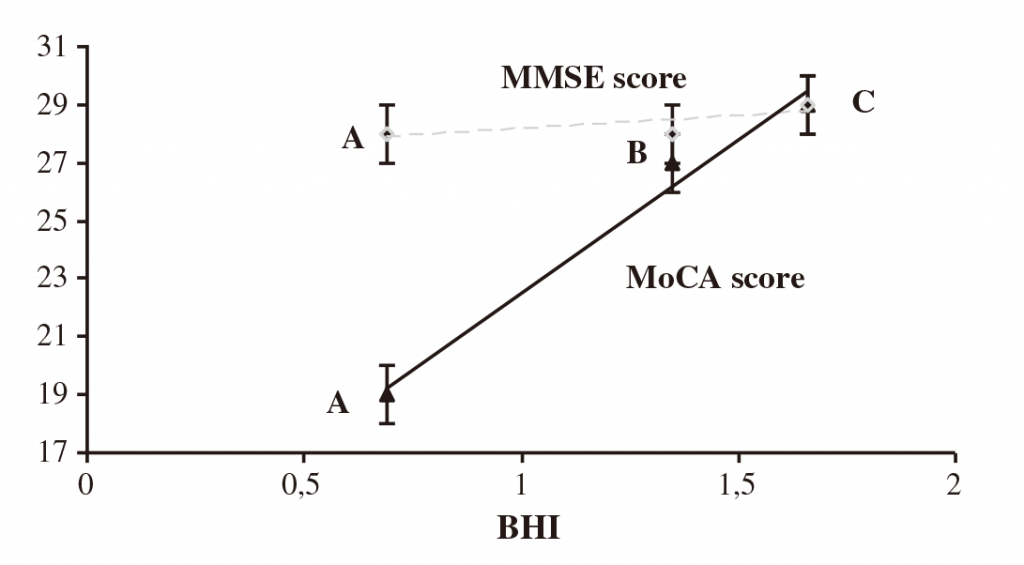
Zavoreo et al, Journal of the Neurological Sciences, 2010, 299: 116-119.
抗加齢ドック受診者における加齢と血管形態・機能解析
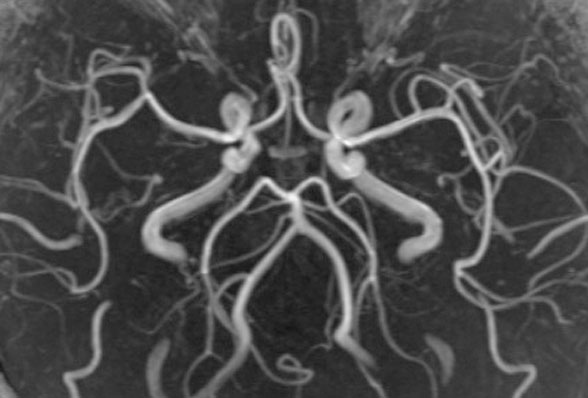
脳微小循環や血管形態と加齢による変化を検討します。また、MRA、頸動脈エコーなどによる血管形態評価と,認知機能,脈管機能や加齢による変化を解析します。

