終了報告の手続きについて
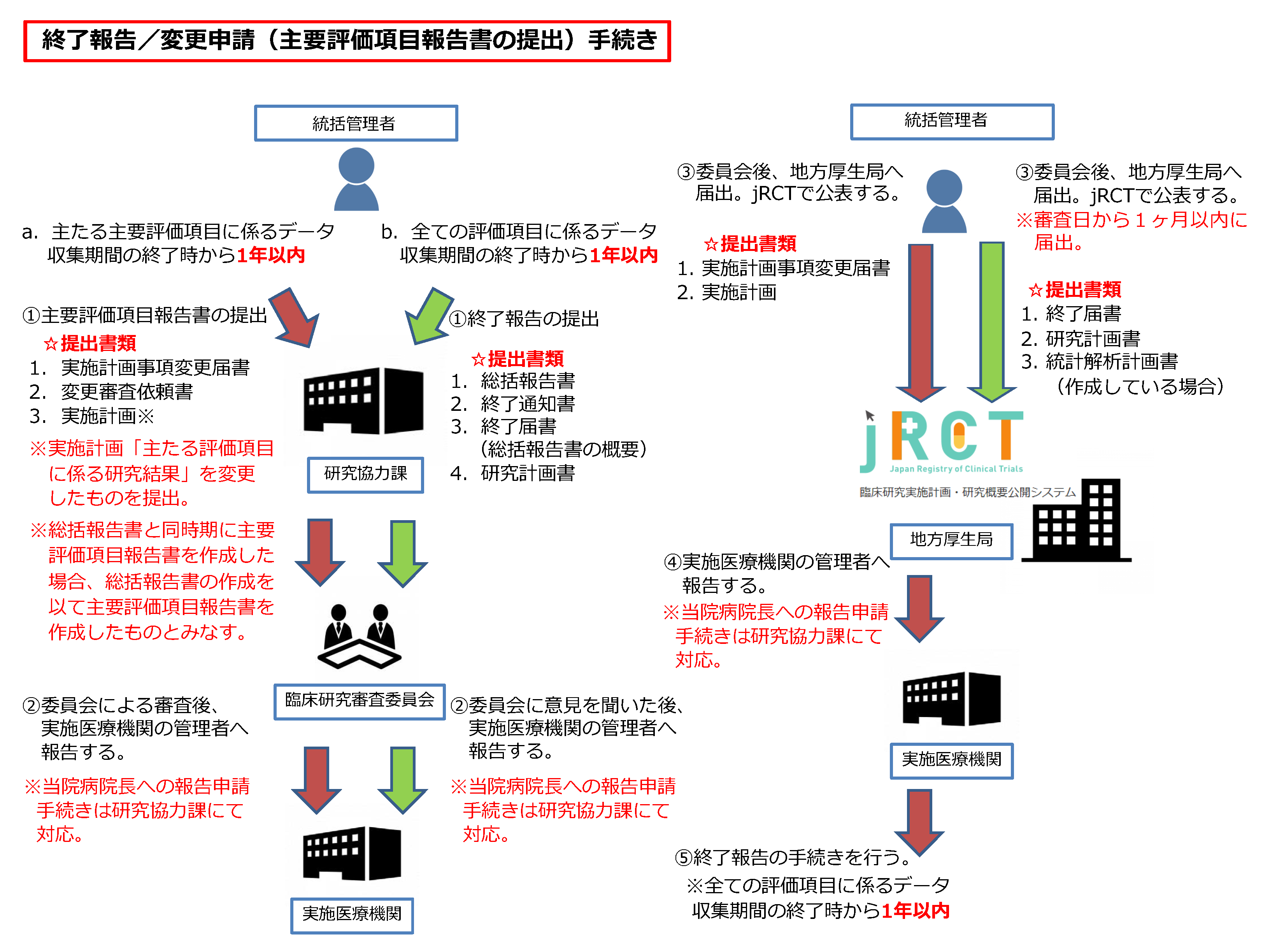
臨床研究法の下で行われる研究は、研究の終了時に主要評価項目報告書や総括報告書の作成および提出が求められます。統括管理者は、研究が終了する際に以下のフローチャートを確認した上で手続きを行ってください。
PDF表示はこちら
主要評価項目報告書について
統括管理者は、主要評価項目報告書又は総括報告書およびその概要の作成とjRCTでのデータ公表が義務付けられています。主要評価項目に係るデータ収集期間が終了した際は、必要書類の作成および手続きを行ってください。
※主要評価項目報告書と総括報告書の作成が同時期の場合、総括報告書の作成を以て前者を作成したものとみなします。また、手続きについては下記掲載の「終了報告について」の手順にて対応お願いします。
主要評価項目報告書または総括報告書の作成
統括管理者は、主要評価項目に係るデータ収集期間の終了から1年以内に、主要評価項目報告書または総括報告書および総括報告書の概要(終了届書(別紙様式1))を作成する。
・主要評価項目報告書を作成した場合
実施計画の変更が伴うため変更申請を行ってから終了報告となります。
・主要評価項目報告書と総括報告書の作成が同時期の場合
総括報告書の作成を以て主要評価項目報告書を作成したものとみなします。
この場合、変更申請の必要はありません。
CRB(認定臨床研究審査委員会)への提出(変更申請)
統括管理者は、主要評価項目報告書とともに変更審査依頼書、実施計画事項変更届書、実施計画を認定臨床研究審査委員会へ提出し、意見を聴く。
実施医療機関の管理者への報告
統括管理者は、主要評価項目報告書または総括報告書及びその概要を作成したときは、遅滞なく、実施医療機関の管理者に報告する。
地方厚生局へ提出およびjRCTでの公表
CRBが意見を述べた日から1ヶ月以内に、jRCTにて主要評価項目に関する情報を入力する。
※jRCTの登録・利用方法 ➡ jRCT操作マニュアル【登録者編】
※審査した機関を管理する地方厚生局の管轄となります。
※申請者が統括管理者の場合、jRCTに公表したことを各研究責任医師へ連絡お願いします。
※届出した際、CRB事務局(研究協力課)まで通知をお願いします。
▼愛媛大学臨床研究審査委員会で審査・承認を受けた場合のお問い合わせ先▼
「中国四国厚生局 健康福祉部 医事課」宛
(〒730-0017 広島県広島市中区鉄砲町 7-18 東芝フコク生命ビル 2 階)
提出書類
| 変更申請(主要評価項目報告書を作成した場合) |
| ・主要評価項目報告書 |
書式なし(任意の書式) |
| ・変更審査依頼書(統一書式3) |
 |
・変更後の実施計画(様式第一)※jRCTで修正
・実施計画事項変更届書(様式第二)※jRCTで作成
※jRCTで入力、一時保存後PDFで提出 |
 (様式第一) (様式第一)
 (様式第二) (様式第二) |
終了報告について
統括管理者は、研究が終了する際に総括報告書およびその概要を作成し、厚生労働大臣(地方厚生局)に報告することが義務付けられています。下記を参考に手続きを進めてください。
総括報告書および終了届書(総括報告書の概要)の作成
全ての評価項目に係るデータ収集期間を終えた後、1年以内に総括報告書および終了届書(総括報告書の概要)を作成する。また、研究計画書の改訂や実施計画に変更があった場合、必ず先に変更申請を行う必要があります。
CRBへ提出※
統括管理者は総括報告書および終了届書(総括報告書の概要)、終了通知書、研究計画書の最終版をCRBへ提出し、意見を聴く。
※委員会への提出時に論文投稿中の場合、その旨を報告していればjRCT公表は論文公表後でも問題ありません。ただし、厚生局への報告は期限内に行い、その際に論文公表時期について伝達お願いします。
※論文公表後、jRCT内の「結果に関する最初の出版物での発表」および「結果と出版物に関するURL」を更新することで情報開示を行う。
実施医療機関の管理者への報告
統括管理者は、主要評価項目報告書または総括報告書及びその概要を作成したときは、遅滞なく、実施医療機関の管理者に報告する。
地方厚生局への届出およびjRCTでの公表
CRBが意見を述べた日から1ヶ月以内に、終了届書(総括報告書の概要)・研究計画書(最終版)・(作成している場合のみ)統計解析計画書 を地方厚生局に届出、jRCTにて終了届書(総括報告書の概要)の公表を行う。
※jRCTの登録・利用方法 ➡ jRCT操作マニュアル【登録者編】
※審査した機関を管理する地方厚生局が管轄となります。
※申請者が統括管理者の場合、jRCTに公表したことを各研究責任医師へ連絡お願いします。
※届出した際、CRB事務局(研究協力課)まで通知をお願いします。
▼愛媛大学臨床研究審査委員会で審査・承認を受けた場合のお問い合わせ先▼
「中国四国厚生局 健康福祉部 医事課」宛
(〒730-0017 広島県広島市中区鉄砲町 7-18 東芝フコク生命ビル 2 階)
提出書類
| 終了報告 |
| ・終了通知書(統一書式12) |
 (書式)/ (書式)/ (記載例) (記載例) |
・終了届書(別紙様式1)=総括報告書の概要
※jRCTで入力、一時保存後PDFで提出 |
 (様式)/ (様式)/ (記載例) (記載例) |
| ・総括報告書 |
書式なし(任意の書式) |
| ・研究計画書・説明文書 ※改訂した場合 |
書式なし(任意の書式) |
| ・統計解析計画書 ※作成した場合 |
書式なし(任意の書式) |
多施設共同研究に参加している場合の終了報告について
他機関の統括管理者が行う多施設共同研究に参加している場合、終了報告の手続きは統括管理者が行います。手続き完了後、統括管理者がjRCTにて公開した情報を研究責任医師に共有します。実施医療機関の管理者へ報告しなければならないため、共有された書類一式と報告申請書とともに研究協力課までご提出をお願いします。
提出書類
| 報告申請 |
| ・報告申請書(特定臨床研究等様式07号) |
 (様式)/ (様式)/ (記載例) (記載例) |