愛媛大学医学部附属病院臨床研究支援センターは、全科の専門医師とともに臨床試験を推進します。(センター長 永井 将弘)


研究責任医師は、疾病等(特定臨床研究の実施に起因するものと疑われる疾病、障害もしくは死亡または感染症(臨床検査値の異常や諸症状を含む))のうち重篤な疾病等の発生を知ったときは、実施医療機関の管理者に報告した上で、認定臨床研究審査委員会に報告し、継続の可否についての審査を受けなければならないこととなっています。 また、重篤な疾病等の一部については、厚生労働大臣への報告が必要です。
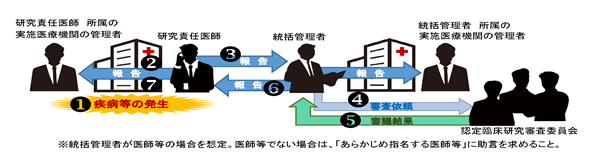
疾病等報告が必要となるものは、未承認・適応外の医薬品等を用いた特定臨床研究に限られ、そのなかでも、特定臨床研究との因果関係が予測されない(未知)、重篤な有害事象のみが対象となる。
特定臨床研究の実施に起因するものと疑われる疾患等の発生に関する事項で厚生労働省令に定めるものを知ったときは、厚生労働大臣へ報告しなければならない。
下記、参考資料を基に厚生労働大臣への報告が必要かどうか、統括管理者が判断を行う。
| 疾病等 有害事象発生時 ※ご相談・ご質問等は「相談窓口」へ | |
| 疾病等報告 | |
| ・医薬品の疾病等報告書(統一書式8) | |
| ・医療機器の疾病等又は不具合報告書(統一書式9) | |
| ・再生医療等製品の疾病等又は不具合報告書(統一書式10) | |
| ・詳細記載用書式*1(統一書式8~10の詳細記載用) | |
| ・疾病等報告書(医薬品)*2(別紙様式2-1) | |
| ・疾病等報告書(医療機器)*2(別紙様式2-2) | |
| 簡便な審査/緊急な審査が必要な場合 | |
| ・簡便な審査申請書(特定臨床研究等様式08号) | |
| ・緊急な審査申請書(特定臨床研究等様式09号) | |
