愛媛大学医学部附属病院臨床研究支援センターは、全科の専門医師とともに臨床試験を推進します。(センター長 永井 将弘)


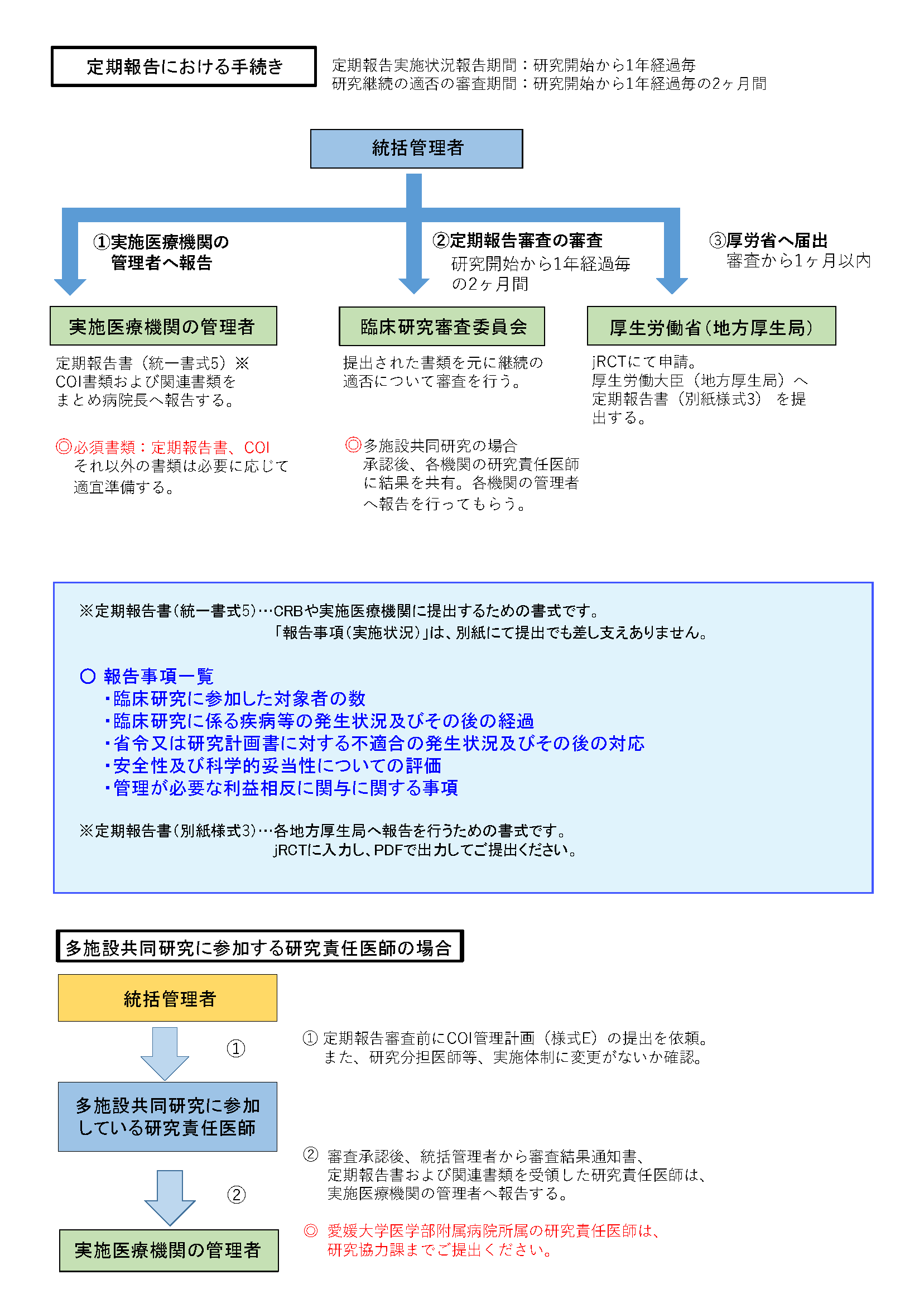
臨床研究審査委員会にて承認された臨床研究は、jRCT公表後から1年経過するタイミングで「定期報告」を行うことが臨床研究法第17条・第18条、施行規則第59条・第60条によって定められています。
統括管理者は、下記掲載の概要および本ページの手順をご確認いただき、研究公表から1年経過後2ヶ月の間に定期報告の審査を受け、審査後1ヶ月以内に厚生労働省に報告を行ってください。
contentsに戻る |
愛媛大学臨床研究審査委員会にて審査を受けた統括管理者は、以下の手順にそって定期報告を行ってください。
contentsに戻る |
| 定期報告 | |
| ・定期報告書(統一書式5) | |
| ・定期報告書(別紙様式3)*1 ※jRCTで入力、一時保存後PDFで提出 |
|
| ・利益相反管理基準(様式A) ・利益相反管理計画(様式E) |
|
| ・審査料支払申込書(特定臨床研究等様式01号) | |
| ・報告申請書*2(特定臨床研究等様式07号) | |
| ※実施した際、提出お願いします。ご不明な場合「相談窓口」へ。 | |
| ・モニタリング報告書および各種報告書*3 | 書式なし(任意の書式) |
contentsに戻る |
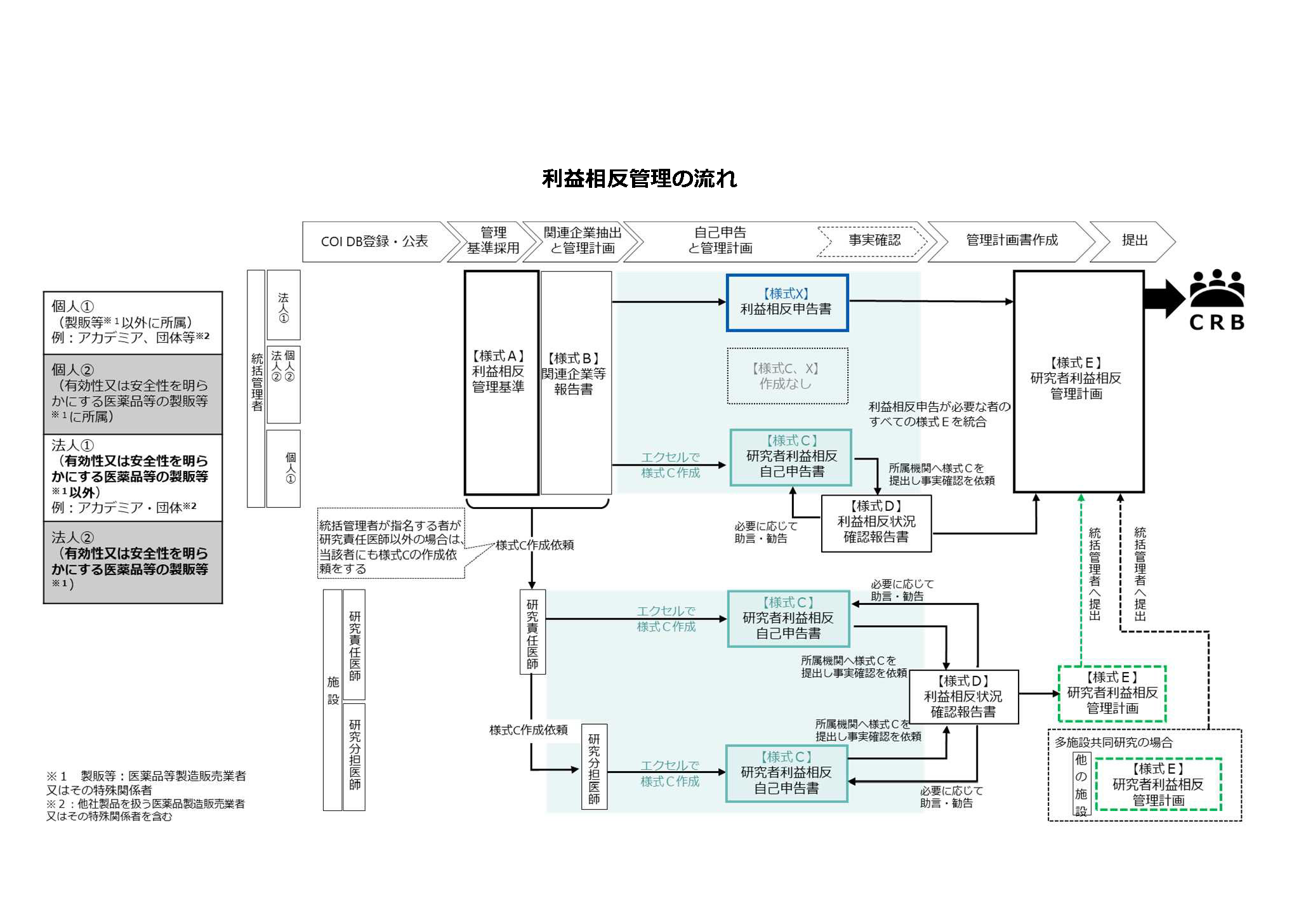
統括管理者には利益相反管理基準(様式A)・関係企業等報告書(様式B)・研究者利益相反自己申告書(様式C)を提出いただいた後、COI部会にて利益相反の事実確認を行います。
その後、利益相反状況確認報告書(様式D)を統括管理者に送付しますので、それを元に利益相反管理計画(様式E)を作成し、CRB事務局へ提出をお願いします。
以下に利益相反のおおまかな流れを掲載しておりますのでご確認ください。
| 利益相反管理 | |
|
・利益相反管理基準(様式A) ・関係企業等報告書(様式B) ・研究者利益相反自己申告書(様式C) ・利益相反状況確認報告書(様式D)※ ※所属機関のCOI部署より研究責任医師に送付 ・利益相反管理計画(様式E) |
|
contentsに戻る |
他機関代表の多施設共同研究に参加している場合、統括管理者が定期報告の手続きを行います。定期報告の審査後、統括管理者は各研究責任医師に情報共有と管理者への報告資料として、承認された定期報告書及び関連書類、審査結果通知書を送付します。
多施設共同研究に参加しており、定期報告に関する書類を受領した研究責任医師は、管理者への報告申請が必要です。すみやかに研究協力課までご提出ください。
contentsに戻る |
